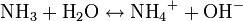1. Introdução
Todos os seres vivos necessitam de matéria-prima para seu crescimento, reprodução, desenvolvimento e reparação de perdas. Necessitam também de energiapara a realização de seus processos vitais. Essas necessidades são supridas pelo alimento orgânico.
Os seres autótrofos sintetizam seus próprios alimentos através da fotossíntese ou da quimiossíntese. O alimento produzido pelos autótrofos é utilizado por eles mesmos e pelos organismos heterótrofos. Os principais produtores da Terra são os organismos fotossintetizantes.
A energia luminosa do Sol é fixada pelo autótrofo e transmitida, sob a forma de energia química, aos demais seres vivos. Essa energia, no entanto, diminui à medida que passa pelos consumidores, pois parte dela é utilizada para a realização dos processos vitais do organismo e outra perde-se sob a forma de calor; sempre restará, portanto, apenas uma parcela menor de energia disponível para o nível seguinte. Como na transferência de energia entre os seres vivos não há reaproveitamento da energia liberada, diz-se que essa transferência é unidirecional e se dá como um fluxo de energia. A matéria, no entanto, pode ser reciclada; fala-se, então, em ciclo da matéria ou ciclo biogeoquímico.
2. Pirâmides ecológicas
As transferências de matéria e de energia nos ecossistemas são freqüentemente representadas de forma gráfica, mostrando as relações entre os diferentes níveis tróficos em termos de quantidade. Como há perda de matéria e de energia em cada nível trófico, as representações adquirem a forma de pirâmides.
As pirâmides ecológicas podem ser de número, de biomassa ou de energia.
2.1 Pirâmide de números
Indica o número de indivíduos em cada nível trófico. Por exemplo: em um campo, 5000 plantas são necessárias para alimentar 300 gafanhotos, que servirão de alimento para apenas uma ave. Nesse exemplo, a pirâmide tem o ápice para cima: é necessário grande número de produtores para alimentar uns poucos herbívoros que, por sua vez, servirão de alimento para um número ainda menor de carnívoros.
Em uma floresta, uma única árvore pode sustentar grande número de herbívoros. Nesse caso, a pirâmide terá a forma inversa.
2.2 Pirâmide de biomassa
A biomassa é expressa em termos de quantidade de matéria orgânica por unidade de área, em um dado momento.
A forma da pirâmide de biomassa também poder variar, dependendo do ecossistema. De modo geral, a biomassa dos produtores é maior que a de herbívoros, que é maior que a de carnívoros. Nesses casos, a pirâmide apresenta o ápice voltado para cima. Isso ocorre nos ecossistemas terrestres, em que, em geral, os produtores têm grande porte.
Às vezes, no entanto, a pirâmide de biomassa apresenta-se invertida, como pode ocorrer nos oceanos e nos lagos, onde os produtores são pequenos e rapidamente consumidos pelos consumidores primários.
2.3 Pirâmide de energia
A pirâmide de energia é construída levando-se em consideração a biomassa acumulada por unidade de área (ou volume) por unidade de tempo em cada nível trófico. Por considerar o fator tempo, a pirâmide de energia nunca é invertida.
Estima-se que apenas cerca de 10% da energia disponível em um nível trófico sejam utilizados pelo nível trófico seguinte. Por exemplo:
Por causa dessa redução da energia disponível a cada nível trófico, dificilmente há mais do que cinco elos em uma cadeia alimentar.
3. O modelo do fluxo energético
Apesar de as pirâmides de energia constituírem uma das melhores maneiras de se representar a transferência de matéria e de energia nos ecossistemas, elas possuem três inconvenientes básicos, comuns também às outras pirâmides ecológicas. Elas não representam:
os decompositores, que são uma parte importante dos ecossistemas;
a matéria orgânica armazenada, que é a matéria não utilizada e não decomposta;
a importação e a exportação de matéria orgânica de e para outros ecossistemas, uma vez que os ecossistemas são sistemas abertos, realizando intercâmbio uns com os outros.
A melhor maneira de representar todos esses fatores é através do modelo do fluxo energético.
4. Os ciclos biogeoquímicos
A biogeoquímica é uma ciência que estuda a troca de materiais entre os componentes bióticos e abióticos da biosfera.
Os seres vivos mantêm constante troca de matéria com o ambiente. Os elementos químicos são retirados do ambiente, utilizados pelos seres vivos e novamente devolvidos ao ambiente, num processo que constitui os ciclos biogeoquímicos.
Vamos analisar, aqui, os ciclos dos quatro elementos químicos que entram na composição da matéria orgânica: o carbono, o hidrogênio, o oxigênio e onitrogênio. Desses quatro elementos, o hidrogênio e o carbono não têm existência livre na biosfera, sendo encontrados associados ao oxigênio, formando, respectivamente, água e gás carbônico. Por essa razão, as trocas de hidrogênio e de carbono entre os seres vivos e o ambiente são estudadas nos ciclos da água e do gás carbônico. Discutiremos aqui, então, quatro ciclos biogeoquímicos: o da água, o do gás carbônico, o do oxigênio e o do nitrogênio.
4.1 Ciclo da Água
Na natureza, a água é encontrada em três estados físicos: sólido, líquido e gasoso. A maior parte, aproximadamente 98%, está sobre a superfície da Terra sob a forma líquida: são os mares, os rios e as lagoas, além de uma pequena quantidade encontrada no interior do corpo dos seres vivos e no interior do solo.
A água salgada compreende a maior parte da água líquida. A água doce é encontrada sob as formas sólida (75%), líquida (quase 25%) e gasosa, sendo esta última representada por pequeníssima quantidade de vapores de água encontrada na atmosfera.
A pequena, embora importantíssima, quantidade de vapor de água encontrada na atmosfera tem duas origens:
A água que se evapora transporta energia e, à medida que sobe à atmosfera, é resfriada. O resfriamento causa a condensação dos vapores de água, que voltam à superfície terrestre sob a forma líquida (chuva). Havendo resfriamento excessivo, os vapores de água podem dar origem, ainda na atmosfera, à água no estado sólido, que cai sob a forma de neve ou de granizo.
O que se pode concluir dessas informações é que a água está em constante mudança de estado físico e que há permanente troca dessa substância entre a superfície da Terra, os seres vivos e a atmosfera. O conjunto de todos esses processos constitui o ciclo da água na natureza.
4.2 Ciclo do gás carbônico
O gás carbônico é encontrado na atmosfera na proporção aproximada de 0,03% e também, em proporção semelhante, dissolvido nas águas superficiais de mares, rios e lagos. O gás carbônico é retirado do ar ou da água pelo processo de fotossíntese e a eles devolvido pela respiração.
A decomposição do corpo de organismos mortos também participa do ciclo do CO2, pois nesse processo os microorganismos oxidam a matéria orgânica, liberando CO2 para a atmosfera.
Outro fator de liberação de gás carbônico para a atmosfera é a queima de combustíveis fósseis, representados principalmente pelo carvão-de-pedra e pelo petróleo.
A constante queima de combustíveis fósseis tem provocado aumento significativo da taxa de gás carbônico no ar, causando grande preocupação em termos do futuro da Terra. Assim, em virtude do aumento do carbono, maior quantidade de calor está sendo retida na atmosfera, pois o CO2 é um dos elementos que contribui para o incremento do efeito estufa.
4.3 Ciclo do Oxigênio
O oxigênio participa não somente da composição da água e do gás carbônico, mas também de numeroso compostos orgânicos e inorgânicos. Na atmosfera e na hidrosfera é encontrado livre, sob a forma de substância pura, simples, de fórmula O2. É uma gás liberado pelos organismos fotossintetizantes, através do processo de fotossíntese. É utilizado para a respiração de plantas e de animais, processo que resulta na produção de gás carbônico.
A manutenção das taxas de oxigênio e de gás carbônico no ambiente depende desses dois processos opostos: a fotossíntese e a respiração. A fotossíntese é realizada somente durante o dia; a respiração é um processo contínuo, realizado pelas plantas e pelos animais, de dia e de noite.
É interessante notar que o oxigênio é uma substância que não somente garante a vida na Terra, mas também origina-se da atividade vital. Praticamente todo o oxigênio livre da atmosfera e da hidrosfera tem origem biológica, no processo de fotossíntese.
O O2 produzido pode participar também da formação da camada de ozônio (O3) na atmosfera. A presença de ozônio na atmosfera é de extrema importância para a humanidade, pelo papel que exerce de filtro das radiações ultravioletas, as quais, úteis em determinada intensidade, são nocivas em intensidades maiores.
A nocividade das radiações ultravioletas está ligada a doenças como o câncer de pele e as alterações genéticas, por induzirem mutações indesejáveis.
A camada de ozônio vem sendo progressivamente destruída, principalmente por ação de um gás conhecido por clorofluorcarbono, também designado por suas iniciais, CFC. O clorofluorcarbono é utilizado em sprays (aerossóis), condicionadores de ar, geladeiras, espuma plástica, componentes eletrônicos e outros produtos.
O CFC liberado na atmosfera atravessa a troposfera, atingindo a estratosfera, onde se situa a camada de ozônio.
O encontro do CFC com o ozônio determina a redução da quantidade de ozônio pelo seguinte processo:
Existem cálculos que estimam que em 75 anos a vida útil do CFC, e em cerca de 100 mil o número de moléculas de ozônio que podem ser destruídas por um único átomo de cloro. Em virtude dos sérios danos que esse gás pode causar, foi assinado um acordo mundial em 1987, conhecido como Protocolo de Montreal, que prevê a redução do uso desse gás à metade, até 1999. Desde a assinatura do acordo têm-se procurado substitutos para o CFC, existindo já algumas substâncias sendo selecionadas. Uma delas é o hidrofluorcarbono (HFC), que contém hidrogênio em lugar de cloro.
4.4 Ciclo do Nitrogênio
O nitrogênio é um gás que ocorre na atmosfera na proporção aproximada de 79%. Apesar disso, não é utilizado de forma direta pelos seres vivos, com exceção de alguns microorganismos. Seu aproveitamento pela generalidade dos seres vivos está na dependência de sua fixação e posterior nitrificação.
A fixação do N2 pode ser feita através de radiação ou da biofixação, sendo este último processo o mais importante. A biofixação é realizada por bactérias, cianobactérias e fungos que podem viver livres no solo ou associados a plantas. Esses organismos são os únicos que conseguem transformar o N2 atmosférico em uma forma utilizável pelos seres vivos: a amônia (NH3). Os biofixadores que vivem associados a plantas são mais eficientes nesse processo que os de vida livre. Isso porque a planta fornece um hábitat apropriado, geralmente nódulos nas raízes, que protege esses microorganismos contra um excesso de O2 (o qual inibe a fixação do nitrogênio) e fornece energia para a realização do processo. Em troca, a planta recebe um farto suprimento de nitrogênio sob a forma assimilável.

A amônia produzida pelos biofixadores associados é incorporada diretamente aos aminoácidos da planta onde vivem. Já a amônia produzida pelos biofixadores de vida livre é transformada em nitrito e depois em nitrato, pela ação das bactérias nitrificantes (Nitrosomonas e Nitrobacter). Essas bactérias são autótrofas quimiossintetizantes, que utilizam a energia da nitrificação para a síntese de suas substâncias orgânicas.
O nitrato pode ser absorvido pelos vegetais e o nitrogênio nele contido é utilizado na síntese de aminoácidos, proteínas e ácidos nucléicos. Essas substâncias são transferidas direta ou indiretamente para os animais, ao longo das cadeias alimentares. Os animais, portanto, só conseguem captar o nitrogênio indispensável para a síntese de suas proteínas e ácidos nucléicos ingerindo diretamente plantas ou, indiretamente, alimentando-se de outros animais da cadeia alimentar.
O nitrogênio deixa o corpo dos organismos por dois processos: excreção de produtos nitrogenados e/ou decomposição dos organismos mortos.
Os excretas nitrogenados uréia e ácido úrico são transformados em amônia por bactérias e fungos decompositores. Estes organismos também degradam as substâncias nitrogenadas contidas no corpo dos organismos mortos, transformando-as em amônia.
A amônia pode retornar ao ciclo sendo transformada em nitrito e nitrato pelas bactérias nitrificantes, ou em nitrogênio (N2), por bactérias desnitrificantes. O N2volta para a atmosfera, podendo entrar novamente na fase biológica do ciclo através dos processos de fixação.
5. A dinâmica das comunidades: sucessão ecológica
Os organismos que compõem uma comunidade sofrem influência de seu biótipo, o qual, por sua vez, é modificado localmente em função da atividade desses mesmos organismos. A atuação dos organismos da comunidade sobre o biótipo pode provocar alterações no substrato e em outras condições abióticas locais, tais como temperatura, luz e umidade (microclima). Essas alterações no biótipo, provocadas pela própria atividade dos organismos que nele ocorrem, podem estabelecer condições abióticas favoráveis à instalação de outras espécies e desfavoráveis às espécies já existentes na comunidade.
Assim, apesar de o macroclima ser o mesmo, alterações no substrato e nas condições microclimáticas podem determinar mudanças nas comunidades ao longo do tempo. Essas mudanças acabam estabelecendo uma comunidade estável, auto-regulada, que não sofre alterações significativas em sua estrutura. Essa comunidade estável é denominada comunidade de clímax e a seqüência de estágios de seu desenvolvimento é denominada sucessão ecológica. Cada estágio de sucessão, ou seja, cada comunidade estabelecida durante o desenvolvimento da comunidade clímax, é denominado estágio geral ou série.
A sucessão ecológica pode ser definida em função de três características básicas:
é um processo ordenado e dirigido;
ocorre como resposta às modificações nas condições ambientais locais, provocadas pelos próprios organismos dos estágios serais;
termina com o estabelecimento de uma comunidade clímax, que não mais sofre alterações em sua estrutura, desde que as condições macroclimáticas não se alterem.
A sucessão pode ser primária ou secundária, dependendo de seu estágio inicial.
A sucessão é primária quando o início da colonização ocorre em regiões anteriormente não habitadas. São regiões que não reúnem condições favoráveis à sobrevivência da grande maioria dos seres vivos. É o que acontece, por exemplo, em superfícies de rochas nuas, de dunas de areia recém-formadas e de lavas vulcânicas recentes. Poucas espécies conseguem suportar as condições adversas existentes nesses locais.
A sucessão é secundária quando o desenvolvimento de uma comunidade inicia-se em uma área anteriormente ocupada por outras comunidades bem estabelecidas, como terras de cultura abandonadas, campinas aradas e florestas recém-derrubadas.
As sucessões primárias, em geral, demoram mais tempo do que as secundárias para atingir o clímax. Estudos de sucessão primária em dunas ou em derrames de lava estimam serem necessários pelos menos mil anos para o desenvolvimento de uma comunidade clímax. Por sua vez, a sucessão secundária em terras onde houve derrubada de matas pode levar apenas 100 anos em clima úmido e temperado.
As espécies que iniciam o processo de sucessão são chamadas espécies pioneiras.
As principais tendências da sucessão ecológica podem ser agrupadas em duas categorias principais: a que reúne as características estruturais e a que reúne as características funcionais dos diferentes estágios da sucessão. Na tabela a seguir, encontram-se resumidas essas principais tendências da sucessão, desde o estágio inicial até o clímax.